
|
실험은 엔탈피 즉, 열 함량을 측정하는 실험이다. △H4을 측정하고 △H5와 △H6을 측정하여 엔탈피를 비교해 보았다. 여기서 잠시 생각해야 할 것은 방출된 열량이라 하면 Q값이 음수이어야 하는데, 알다시피 우리가 한 실험값은 양수이다. 그
|
- 페이지 5페이지
- 가격 600원
- 등록일 2007.05.02
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
실험 방법
1. △H1의 측정
① 비커의 정확한 무게를 측정한다.
② 열량계를 조립한다.
㉠ 스티로폼 안에 비커를 넣고 뚜껑을 닫는다.
㉡ 뚜껑의 구멍에 온도계를 꽂는다. (온도계를 꽂은 구멍사이로 빠져나오는 열을 최소 한으로 하기 위해서
|
- 페이지 7페이지
- 가격 1,300원
- 등록일 2007.05.02
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|
|
화학 실험 제6개정판 실험10. 이산화탄소의 승화열 측정
이산화탄소의 승화열 참값 : http://kin.naver.com/detail/detail.php?d1id=11&dir_id=110204&eid=pU2JiTsNj4eX4Jdn73fftVjeQYmcasaJ&qb=7J207IKw7ZmU7YOE7IaMIOyKue2ZlOyXtA==&enc=utf8&pid=fN79gdoi5TNssaWuqGlsss--051788&sid=ScL83bvOwkkAABNoMrw
|
- 페이지 5페이지
- 가격 600원
- 등록일 2009.10.08
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
실험 결과가 얻어질 것이다.
고체 NaOH는 흡습성이 강하므로 신속한 실험 만이 오차를 줄일 수 있을 것이다.
7. 참고문헌 (References)
표준일반화학실험 -천문각- (교재)
http://chem1.snu.ac.kr/~chemlab/exp/exp1-2.htm
일반 화학 (오정근 외 6명, 자유아카데미
|
- 페이지 4페이지
- 가격 1,000원
- 등록일 2015.03.13
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
판단한다. 또한 열역학 제 2법칙에 따라 자발적 변화가 전체 엔트로피 증가를 수반함을 알 수 있다.
4. 참고 문헌
① 일반화학실험 실험자료
② 줌달 일반화학 9판
③ 할리데이 일반물리학 10판 1. 결과
2. 분석
3. 토의
4. 참고 문헌
|
- 페이지 3페이지
- 가격 1,000원
- 등록일 2016.06.24
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
화학반응에 대한 평형조건을 알 수 있다. 깁스 자유에너지와 엔탈피, 엔트로피 관계식은 다음과 같다.
[ G = H TS ] ( H : 엔탈피(enthalpy), T : Kelvin 온도, S : 엔트로피(entropy) )
5. 참고문헌
- 줌달의 일반화학
- genchem.korea.ac.kr 1. 실험결과
2. 오차
|
- 페이지 5페이지
- 가격 6,300원
- 등록일 2017.09.08
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
실험을 해보고 싶다.
<출처>
일반 화학 실험-대한 화학회(p.101~107)
네이버 백과사전
네이버 지식 인
http://blog.naver.com/sosodie/120001142048
http://navercast.naver.com/contents.nhn?contents_id=2416
http://blog.naver.com/arctee/150018453924 1.Title 엔탈피 측정
2.Introduc
|
- 페이지 8페이지
- 가격 2,000원
- 등록일 2015.04.30
- 파일종류 한글(hwp)
- 참고문헌 있음
- 최근 2주 판매 이력 없음
|

|
엔탈피 측정
실험 목표
• 산과 염기의 중화반응을 이용해서 엔탈피가 상태함수임을 확인한다.
≪ 그 림 ≫
열역학 제 1법칙
• 열역학 제 1법칙
우주 내의 물질과 에너지의 총량은 일정.
화학반응과 물리적
|
- 페이지 21페이지
- 가격 12,600원
- 등록일 2012.09.23
- 파일종류 피피티(ppt)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
실험에서 오차들의 요인들이 복잡하지만 결국은 헤스의 법칙을 설명할 수 있다. 한 단계 반응과 그것이 여러 단계로 나누어진 반응에서 경로에 상관없이 결국은 화학 반응에 따르는 에너지 변화는 일정하다는 결론에 이르게 된다. 따라서 헤
|
- 페이지 8페이지
- 가격 1,300원
- 등록일 2008.11.13
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|

|
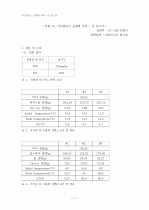
실험 6 엔탈피 변화 측정
1. 실험 데이터 분석방법
(1) 간이 열량계의 열용량 결정
(2) 반응열 측정
(3) 용해열 측정
(4) 중화열 측정
2. 실험 데이터
A,B,C,D - 표, 그래프(liner 되어있음)
3.실험 데이터 분석
(1) 간이 열량계의 열용
|
- 페이지 5페이지
- 가격 1,000원
- 등록일 2008.04.23
- 파일종류 한글(hwp)
- 참고문헌 없음
- 최근 2주 판매 이력 없음
|