목차
1.Title of Experiment
2.Purpose
3.Principle
4.Method & Procedure
5.Apparatus& Reagent
6.Results
7.Discussion
8.Reference
2.Purpose
3.Principle
4.Method & Procedure
5.Apparatus& Reagent
6.Results
7.Discussion
8.Reference
본문내용
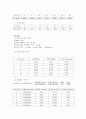
정온도: 25℃
건조한 비중병의 무게 : 20.85g
증류수를 채운 비중병의 무게 : 46.12g
증류수의 밀도 = (46.12g - 20.85g)/25mL = 1.0108(g/ml)
(2) NaCl의 밀도 측정
농도 (wt%)
빈비중병(g)
나중비중병(g)
NaCl의 밀도(g/ml)
2
22.24
47.87
1.025
4
22.34
48.04
1.028
6
28.63
54.46
1.033
8
32.22
57.62
1.016
10
25.87
51.52
1.026
12
24.17
50.60
1.057
(3) 몰랄농도 구하기
용액(NaCl)의
농도(wt%)
용매(물)밀도(g/ml)
용매의 부피(mL)
용질의 몰수(mol)
몰랄농도(mol/kg)
2
1.0108(g/ml)
25mL
0.0171
0.349
4
1.0108(g/ml)
25mL
0.0342
0.713
6
1.0108(g/ml)
25mL
0.0513
1.091
8
1.0108(g/ml)
25mL
0.0684
1.487
10
1.0108(g/ml)
25mL
0.0855
1.9
12
1.0108(g/ml)
25mL
0.1027
2.334
(4) 겉보기부피와 몰랄농도 제곱근 및 분몰랄부피
농도(wt%)
겉보기부피(mL/mol)
몰랄농도 제곱근
분몰랄부피
2
17.74
0.591
36.52
4
33.63
0.844
46.78
6
37.09
1.045
47.71
8
54.11
1.219
63.22
10
49.25
1.378
57.31
12
36.76
1.528
44.02
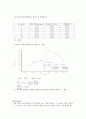
(5) 그래프
① 겉보기 부피와 몰랄농도의 제곱근의 그래프
∴ 기울기 = 22.20 , Y절편 = 4.542
② 기울기와 절편값을 이용해서 몰랄농도와 분몰랄 부피와의 관계와 그 그래프
6.Discussion
이번 실험은 질량 백분율이 다른 일련의 Nacl - H20 용액에서 그 분 몰랄 부피를 측정하는 것 이였다. 이번 실험은 여짓해 해 왔던 몇 안되는 실험들 중에서 가장 편하게 할수 있었던것 같다. 이론도 그냥 보기에는 복잡해 보이지만, 우리가 어떤 식이 어떻게 해서 나왔는지 그것에 대한 모든 과정을 이해 하려 하지만 않는다면, 우리가 구한 측정한 실험 치를 가지고 결과값은 간단한 식을 통해 알아 볼수 있었다.
분몰랄 부피라는 것은 용액 중의 한 성분이 전체 부피에 기여하는 부피를 뜻하며, 물질을 첨가해도 농도의 변화가 일어나지 않을 정도로 충분히 큰 용액 시료에 1몰의 성분을 첨가함으로써 수반되는 용액의 부피 변화이다. 이렇듯 우리가 이번에 하는 실험은 부피의 변화량을 토대로 하는 실험이기 때문에, 우리는 동일온도 같은 압력에서 실험을 하여야 했다. 그래서 우리는 실험시간 내내 동일 온도를 맞추기 위해서 항온조를 사용하여 25℃를 유지 하면서 실험에 임하였다. 그리고 여기서 일정 압력이라는 것은 우리가 따로 어떠한 장치를 하지는 않았지만, 실험 실 자체를 일정한 외부 압력으로 보고 실험에 임한 것이다.
이번 실험의 측정 또한 상당히 간단 하였다. 우선 빈비중병의 무게와 용액을 넣은 나중 비중병의 무게를 제고 그것을 우리가 알고 있는 여러 가지 계산식을 사용하여 위의 실험 결과에 써 놓은 대로 많은 값을 구해 내었다. 그래서 우리가 원하는 궁극적 마지막 목표인 분몰랄 부피의 값을 구해 내게 되었다. 이번 실험이 다른 실험과 약간 틀린 점이 있다면, 이번 실험결과는 오리진 프로그램을 이용해 겉보기 부피와 몰랄농도의 제곱근의 그래프 먼저 그 그래프를 토대로 기울기 값과 Y절편을 이용해서 분 몰랄 부피를 계산 하게 된 것이다.
여짓 것 어떠한 식이 나오고 그것을 parameter, value, error 값을 오리진 프로그램이 보여 주었는데, 그것의 의미를 정확히 알지 못하고, 매번 그래프 그림에서 지우기만 하였는데, 이번 실험을 통해 그것의 의미와 그것을 어떻게 읽는지 또한 알게 되었다.
우리는 이번 실험에서 부피의 값을 알아 내려 하는 실험을 하였는데, 우리는 단순히 부피의 값을 측정하지 않고 그것을 우회적으로 측정하는 방법으로 실험을 하였다. 부피의 대한 정보는 얻기 위해 우리는 밀도값을 이용하였다. 이들은 소량의 용질들을 포함하는 용액에 대해 보고 되어 있으며, 이 용액은 용매라는 주 성분의 정해진 양에 용질이 들어 있는 것을 말한다. 그래서 예비 레포트를 쓸 때도 공기와 물의 밀도를 온도별로 다 조사 한 것이다.
우리는 최종 목표인 분 몰랄 부피를 얻어 내기 위해서 위의 식을 사용하였다. 위의 식이 어떻게 나왔는지는, 예비 레포트에 자세히
건조한 비중병의 무게 : 20.85g
증류수를 채운 비중병의 무게 : 46.12g
증류수의 밀도 = (46.12g - 20.85g)/25mL = 1.0108(g/ml)
(2) NaCl의 밀도 측정
농도 (wt%)
빈비중병(g)
나중비중병(g)
NaCl의 밀도(g/ml)
2
22.24
47.87
1.025
4
22.34
48.04
1.028
6
28.63
54.46
1.033
8
32.22
57.62
1.016
10
25.87
51.52
1.026
12
24.17
50.60
1.057
(3) 몰랄농도 구하기
용액(NaCl)의
농도(wt%)
용매(물)밀도(g/ml)
용매의 부피(mL)
용질의 몰수(mol)
몰랄농도(mol/kg)
2
1.0108(g/ml)
25mL
0.0171
0.349
4
1.0108(g/ml)
25mL
0.0342
0.713
6
1.0108(g/ml)
25mL
0.0513
1.091
8
1.0108(g/ml)
25mL
0.0684
1.487
10
1.0108(g/ml)
25mL
0.0855
1.9
12
1.0108(g/ml)
25mL
0.1027
2.334
(4) 겉보기부피와 몰랄농도 제곱근 및 분몰랄부피
농도(wt%)
겉보기부피(mL/mol)
몰랄농도 제곱근
분몰랄부피
2
17.74
0.591
36.52
4
33.63
0.844
46.78
6
37.09
1.045
47.71
8
54.11
1.219
63.22
10
49.25
1.378
57.31
12
36.76
1.528
44.02
(5) 그래프
① 겉보기 부피와 몰랄농도의 제곱근의 그래프
∴ 기울기 = 22.20 , Y절편 = 4.542
② 기울기와 절편값을 이용해서 몰랄농도와 분몰랄 부피와의 관계와 그 그래프
6.Discussion
이번 실험은 질량 백분율이 다른 일련의 Nacl - H20 용액에서 그 분 몰랄 부피를 측정하는 것 이였다. 이번 실험은 여짓해 해 왔던 몇 안되는 실험들 중에서 가장 편하게 할수 있었던것 같다. 이론도 그냥 보기에는 복잡해 보이지만, 우리가 어떤 식이 어떻게 해서 나왔는지 그것에 대한 모든 과정을 이해 하려 하지만 않는다면, 우리가 구한 측정한 실험 치를 가지고 결과값은 간단한 식을 통해 알아 볼수 있었다.
분몰랄 부피라는 것은 용액 중의 한 성분이 전체 부피에 기여하는 부피를 뜻하며, 물질을 첨가해도 농도의 변화가 일어나지 않을 정도로 충분히 큰 용액 시료에 1몰의 성분을 첨가함으로써 수반되는 용액의 부피 변화이다. 이렇듯 우리가 이번에 하는 실험은 부피의 변화량을 토대로 하는 실험이기 때문에, 우리는 동일온도 같은 압력에서 실험을 하여야 했다. 그래서 우리는 실험시간 내내 동일 온도를 맞추기 위해서 항온조를 사용하여 25℃를 유지 하면서 실험에 임하였다. 그리고 여기서 일정 압력이라는 것은 우리가 따로 어떠한 장치를 하지는 않았지만, 실험 실 자체를 일정한 외부 압력으로 보고 실험에 임한 것이다.
이번 실험의 측정 또한 상당히 간단 하였다. 우선 빈비중병의 무게와 용액을 넣은 나중 비중병의 무게를 제고 그것을 우리가 알고 있는 여러 가지 계산식을 사용하여 위의 실험 결과에 써 놓은 대로 많은 값을 구해 내었다. 그래서 우리가 원하는 궁극적 마지막 목표인 분몰랄 부피의 값을 구해 내게 되었다. 이번 실험이 다른 실험과 약간 틀린 점이 있다면, 이번 실험결과는 오리진 프로그램을 이용해 겉보기 부피와 몰랄농도의 제곱근의 그래프 먼저 그 그래프를 토대로 기울기 값과 Y절편을 이용해서 분 몰랄 부피를 계산 하게 된 것이다.
여짓 것 어떠한 식이 나오고 그것을 parameter, value, error 값을 오리진 프로그램이 보여 주었는데, 그것의 의미를 정확히 알지 못하고, 매번 그래프 그림에서 지우기만 하였는데, 이번 실험을 통해 그것의 의미와 그것을 어떻게 읽는지 또한 알게 되었다.
우리는 이번 실험에서 부피의 값을 알아 내려 하는 실험을 하였는데, 우리는 단순히 부피의 값을 측정하지 않고 그것을 우회적으로 측정하는 방법으로 실험을 하였다. 부피의 대한 정보는 얻기 위해 우리는 밀도값을 이용하였다. 이들은 소량의 용질들을 포함하는 용액에 대해 보고 되어 있으며, 이 용액은 용매라는 주 성분의 정해진 양에 용질이 들어 있는 것을 말한다. 그래서 예비 레포트를 쓸 때도 공기와 물의 밀도를 온도별로 다 조사 한 것이다.
우리는 최종 목표인 분 몰랄 부피를 얻어 내기 위해서 위의 식을 사용하였다. 위의 식이 어떻게 나왔는지는, 예비 레포트에 자세히
추천자료
 화학실험 몰질량의 측정
화학실험 몰질량의 측정 화학실험 - 액체와 고체의 밀도 측정
화학실험 - 액체와 고체의 밀도 측정 화학실험 온도측정과 온도계 보정 결과레포트
화학실험 온도측정과 온도계 보정 결과레포트 일반화학실험 엔탈피측정
일반화학실험 엔탈피측정 일반화학실험 pH측정
일반화학실험 pH측정 일반화학실험-결정장 갈라짐 에너지의 측정 [예비, 결과 보고서]
일반화학실험-결정장 갈라짐 에너지의 측정 [예비, 결과 보고서] 일반화학및실험 토의및고찰 - 질량측정과 액체옮기기
일반화학및실험 토의및고찰 - 질량측정과 액체옮기기 화학실험 - 액체의 점도 측정
화학실험 - 액체의 점도 측정 [일반화학실험] 몰질량의 측정 : 이상기체 상태방정식을 이용하여 쉽게 증발하는 기체의 물질...
[일반화학실험] 몰질량의 측정 : 이상기체 상태방정식을 이용하여 쉽게 증발하는 기체의 물질... [일반화학실험] 엔탈피 측정 : 엔탈피가 상태함수임을 알고 산과 염기의 중화반응을 이용하여...
[일반화학실험] 엔탈피 측정 : 엔탈피가 상태함수임을 알고 산과 염기의 중화반응을 이용하여... 일반화학실험 질량측정과 액체 옮기기 레포트
일반화학실험 질량측정과 액체 옮기기 레포트 일반화학실험 몰질량 측정 레포트
일반화학실험 몰질량 측정 레포트 일반화학실험/ 엔탈피측정
일반화학실험/ 엔탈피측정 일반화학실험 녹는점 측정 레포트
일반화학실험 녹는점 측정 레포트




























소개글