본문내용
줄일 수 도 있다.
중화적정법 |작성자 홍반장
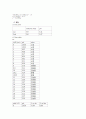
중화반응에서 산과 염기는 당량 대 당량으로 반응하기 때문에 산용액과 염기용액사이에는 다음과 같은 식이 성립된다.
(산의 당량 수) = (염기의 당량 수)
표준물질을 만들 때 Na₂CO₃에서 약 50 mL의 증류수를 넣는데, Na₂CO₃ 10 mL 나 Na₂CO₃ 10 mL에 물을 가한 용액 모두 그 안에 들어있는 Na₂CO₃의 양에는 변함없이 일정하다. 따라서 소비되는 적정액의 양도 같다. 다만 이렇게 희석조작을 하는 것은 시험조작의 용이성을 위한 것이다. 플라스크에 10 mL 의 시료만 채취했다면 마그네틱바를 이용해 교반하면서 적정 시 바가 잠기지도 않아 사방으로 비산 하거나 pH meter가 충분히 용액에 잠기지않는 등 조작상의 문제가 발생한다. 양이 너무 작으면 지시약 변화상태 관찰도 용이하지 않기 때문에 증류수를 섞어준다.
이번 실험에서 주의해야 할 사항이 몇 가지 있는데 뷰렛을 이용할 때, 뷰렛이 깨끗하지 못하면 유리표면에 물방울이 달라붙게 되며, 그렇게 되면 부피측정에 오차가 나게 된다. 또한 뷰렛의 콕크를 잠깐 동안 열어서 용액을 약간 흘려내려서 콕크 아랫 부분에 남아 있는 공기를 밀어낸 다음 콕크를 잠가야 정확한 부피 측정을 할 수 있다.
그리고 지시약은 그 자체가 약한 산이나 약한 염기인 복잡한 유기 화합물이므로 소량 사용해서 오차를 줄여야 한다. 또한 지시약의 종류에 따라서 색이 바뀌는 pH 범위가 다르기 때문에 적정하는 산과 염기의 종류에 따라서 적당한 지시약을 선택해야 적정의 불확실도를 줄일 수 있다. 또 이 실험에서는 magnetic Bar를 넣어주는 데 한 방울씩 떨어지는 NaOH 용액과 계속해서 잘 섞이도록 하기 위해 넣어준다. 마그네틱 바를 이용하지 않고 플라스크를 손으로 흔들어도 되나, 마그네틱 바를 이용해 플라스크는 고정시켜놓고 색을 관찰하는 것이 훨씬 편하다. 또 진한 염산은 휘발성이 강한 액체로서 그 기체는 유독하므로 Fume Hood 안에서 pipet filler를 사용하여 액을 취한다.
pH 지시약은 각각 변색하는 pH범위가 정해져 있다. 그 범위를 변색범위라 하고 이 범위를 변색범위라 하고 이 범위보다 산성측으로 나타나는 색을 산성색, 또 알칼리성 측으로 나타내는 색을 알칼리성색이라 한다.
pH지시약의 변색범위
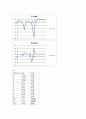
부피에 따라 pH meter에서 측정된 e.p 와 지시약을 이용한 e.p가 다른 이유도 지시약의 변색범위가 크기 때문에 정확히 표준화된 점을 찾기어렵기 때문이다.
표준용액(standard solution)은 정량분석의 기준용액으로 사용되는 것으로서 시료를 분석하기에 앞서 반드시 그 농도가 정확히 알려져 있어야 한다. 그러기 위해서는 해당하는 순수한 물질을 정확히 칭량하여 일정 용량의 용액으로 하면 된다. 그러나 실제로 시약을 순수한 상태로 얻기 어렵다든가 또는 농도가 불확실한 액체 등의 경우에는 표준용액과 정량적으로 반응하여, 정확한 칭량이 가능한 순수한 물질을 찾아 정확한 농도의 용액을 만들고 이것을 대체적인 농도로 조제해 놓은 표준용액으로 적정하여 그적정량으로부터 표준용액의 농도를 올바르게 산출하는 방법이 취해진다. 용량분석에 사용되는 표준용액은 주로 노르말농도이며 간혹 킬레이트 적정에 몰농도가 사용된다. 이와같이 표준용액의 실제농도를 결정하는 조작을 표정(standardization)이라 하고 표정에 사용되는 순수하며 일정조성을 갖고 있는 물질을 표준물질(standard substance)이라고 한다. 표준용액의 역가|작성자 환장헐
표준물질은
① 구입하기 쉽고 조성이 변화하지 않으며 정제, 건조할 수 있어야 한다.
② 칭량중 공기에 의하여 산화되지 않고 수분이나 이산화탄소를 흡수하지 않아야 한다.
③ 물에 잘 녹아야 한다.
④ 표정시 반응이 정량적이고 빠르게 진행되어야 한다.
⑤ 칭량오차를 작게 할 수 있으므로 g 당량이 큰 것이 좋다.
pH미터 사용법과 원리
pH meter 원리
가장 널리 쓰이는 이온선택성 전극은 pH 측정에 쓰이는 유리전극(glass elecrode)이다. 전지의 pH 감지 부분은 전극의 아래에 있는 얇은 유리막이다.
pH meter 사용법
1) 전원을 키고 전극을 증류수로 깨끗이 닦는다.
2) MODE를 이용하여 25℃ 정확한 온도를 TEMP로 조정한다.
3) pH 7.00 표준용액으로 CALB를 돌려 보정하고 HOLD를 누른다.
5) 전극을 증류수로 잘 닦은 후 사용하고자 하는 Sample의 pH를 측정한다.
6) pH meter를 사용한 후에는 전극을 증류수로 깨끗이 닦은 후에 전극이 마르지 않도록 증류수에 넣어 보관한다.
pH meter 주의 할 점
pH meter는 매우 정교한 기기이므로 조심스럽게 다룬다.
- 전극을 뒤집어들지 않는다.
- 전극을 용액을 젓는데 사용하거나 흔들지 않는다.
- 전극은 항상 깨끗하게 보관한다.
- 전극에 충격이 가지 않도록 주의한다. (magnetic bar와 충돌 주의)
- 전극은 항상 젖어있어야 하기 때문에 사용 후 증류수로 여러 번 씻고 보관액에 담가둔다. 이때 전극을 휴지로 닦아서는 안된다.
9. Reference
분석화학 Ⅰ 기초편 제 4판
저자 : G.DChristian
이용근 박윤창 박정학 이동수 팽기정 황훈 공역
출판사 : 사이텍 미디어
2008년도
분석화학 제 7판
분석화학교재연구회
출판사 : 자유아카데미
저자 : D.A.Skoog, DM.West, F.J.Holler
2000년 3월 5일 발행
분석화학 제 4판
저자 : Daniel.C.Harris
자유아카데미
1997년 8월 1일 발행
환경인은 위한 분석화학실험
동화기술
박승조,팽성관,장철현,배준현 공저
2000년도
일반화학실험
제 5호
공주대학교출판부
저자: 공주대학교사범대학화학교육과
오제직,김재현,류해일,홍춘표
1999년도
THE MERCK INDEX
12 edition
MERCK & CO.,INC
Paul G. Stecher
1996년도
HACKH′S CHEMICAL DICTIONARY
4th edtion
McGRAW-HILL BOOK COMPANY
Julius Grant 1
972년도
네이버 위키피디어
중화적정법 |작성자 홍반장
중화반응에서 산과 염기는 당량 대 당량으로 반응하기 때문에 산용액과 염기용액사이에는 다음과 같은 식이 성립된다.
(산의 당량 수) = (염기의 당량 수)
표준물질을 만들 때 Na₂CO₃에서 약 50 mL의 증류수를 넣는데, Na₂CO₃ 10 mL 나 Na₂CO₃ 10 mL에 물을 가한 용액 모두 그 안에 들어있는 Na₂CO₃의 양에는 변함없이 일정하다. 따라서 소비되는 적정액의 양도 같다. 다만 이렇게 희석조작을 하는 것은 시험조작의 용이성을 위한 것이다. 플라스크에 10 mL 의 시료만 채취했다면 마그네틱바를 이용해 교반하면서 적정 시 바가 잠기지도 않아 사방으로 비산 하거나 pH meter가 충분히 용액에 잠기지않는 등 조작상의 문제가 발생한다. 양이 너무 작으면 지시약 변화상태 관찰도 용이하지 않기 때문에 증류수를 섞어준다.
이번 실험에서 주의해야 할 사항이 몇 가지 있는데 뷰렛을 이용할 때, 뷰렛이 깨끗하지 못하면 유리표면에 물방울이 달라붙게 되며, 그렇게 되면 부피측정에 오차가 나게 된다. 또한 뷰렛의 콕크를 잠깐 동안 열어서 용액을 약간 흘려내려서 콕크 아랫 부분에 남아 있는 공기를 밀어낸 다음 콕크를 잠가야 정확한 부피 측정을 할 수 있다.
그리고 지시약은 그 자체가 약한 산이나 약한 염기인 복잡한 유기 화합물이므로 소량 사용해서 오차를 줄여야 한다. 또한 지시약의 종류에 따라서 색이 바뀌는 pH 범위가 다르기 때문에 적정하는 산과 염기의 종류에 따라서 적당한 지시약을 선택해야 적정의 불확실도를 줄일 수 있다. 또 이 실험에서는 magnetic Bar를 넣어주는 데 한 방울씩 떨어지는 NaOH 용액과 계속해서 잘 섞이도록 하기 위해 넣어준다. 마그네틱 바를 이용하지 않고 플라스크를 손으로 흔들어도 되나, 마그네틱 바를 이용해 플라스크는 고정시켜놓고 색을 관찰하는 것이 훨씬 편하다. 또 진한 염산은 휘발성이 강한 액체로서 그 기체는 유독하므로 Fume Hood 안에서 pipet filler를 사용하여 액을 취한다.
pH 지시약은 각각 변색하는 pH범위가 정해져 있다. 그 범위를 변색범위라 하고 이 범위를 변색범위라 하고 이 범위보다 산성측으로 나타나는 색을 산성색, 또 알칼리성 측으로 나타내는 색을 알칼리성색이라 한다.
pH지시약의 변색범위
부피에 따라 pH meter에서 측정된 e.p 와 지시약을 이용한 e.p가 다른 이유도 지시약의 변색범위가 크기 때문에 정확히 표준화된 점을 찾기어렵기 때문이다.
표준용액(standard solution)은 정량분석의 기준용액으로 사용되는 것으로서 시료를 분석하기에 앞서 반드시 그 농도가 정확히 알려져 있어야 한다. 그러기 위해서는 해당하는 순수한 물질을 정확히 칭량하여 일정 용량의 용액으로 하면 된다. 그러나 실제로 시약을 순수한 상태로 얻기 어렵다든가 또는 농도가 불확실한 액체 등의 경우에는 표준용액과 정량적으로 반응하여, 정확한 칭량이 가능한 순수한 물질을 찾아 정확한 농도의 용액을 만들고 이것을 대체적인 농도로 조제해 놓은 표준용액으로 적정하여 그적정량으로부터 표준용액의 농도를 올바르게 산출하는 방법이 취해진다. 용량분석에 사용되는 표준용액은 주로 노르말농도이며 간혹 킬레이트 적정에 몰농도가 사용된다. 이와같이 표준용액의 실제농도를 결정하는 조작을 표정(standardization)이라 하고 표정에 사용되는 순수하며 일정조성을 갖고 있는 물질을 표준물질(standard substance)이라고 한다. 표준용액의 역가|작성자 환장헐
표준물질은
① 구입하기 쉽고 조성이 변화하지 않으며 정제, 건조할 수 있어야 한다.
② 칭량중 공기에 의하여 산화되지 않고 수분이나 이산화탄소를 흡수하지 않아야 한다.
③ 물에 잘 녹아야 한다.
④ 표정시 반응이 정량적이고 빠르게 진행되어야 한다.
⑤ 칭량오차를 작게 할 수 있으므로 g 당량이 큰 것이 좋다.
pH미터 사용법과 원리
pH meter 원리
가장 널리 쓰이는 이온선택성 전극은 pH 측정에 쓰이는 유리전극(glass elecrode)이다. 전지의 pH 감지 부분은 전극의 아래에 있는 얇은 유리막이다.
pH meter 사용법
1) 전원을 키고 전극을 증류수로 깨끗이 닦는다.
2) MODE를 이용하여 25℃ 정확한 온도를 TEMP로 조정한다.
3) pH 7.00 표준용액으로 CALB를 돌려 보정하고 HOLD를 누른다.
5) 전극을 증류수로 잘 닦은 후 사용하고자 하는 Sample의 pH를 측정한다.
6) pH meter를 사용한 후에는 전극을 증류수로 깨끗이 닦은 후에 전극이 마르지 않도록 증류수에 넣어 보관한다.
pH meter 주의 할 점
pH meter는 매우 정교한 기기이므로 조심스럽게 다룬다.
- 전극을 뒤집어들지 않는다.
- 전극을 용액을 젓는데 사용하거나 흔들지 않는다.
- 전극은 항상 깨끗하게 보관한다.
- 전극에 충격이 가지 않도록 주의한다. (magnetic bar와 충돌 주의)
- 전극은 항상 젖어있어야 하기 때문에 사용 후 증류수로 여러 번 씻고 보관액에 담가둔다. 이때 전극을 휴지로 닦아서는 안된다.
9. Reference
분석화학 Ⅰ 기초편 제 4판
저자 : G.DChristian
이용근 박윤창 박정학 이동수 팽기정 황훈 공역
출판사 : 사이텍 미디어
2008년도
분석화학 제 7판
분석화학교재연구회
출판사 : 자유아카데미
저자 : D.A.Skoog, DM.West, F.J.Holler
2000년 3월 5일 발행
분석화학 제 4판
저자 : Daniel.C.Harris
자유아카데미
1997년 8월 1일 발행
환경인은 위한 분석화학실험
동화기술
박승조,팽성관,장철현,배준현 공저
2000년도
일반화학실험
제 5호
공주대학교출판부
저자: 공주대학교사범대학화학교육과
오제직,김재현,류해일,홍춘표
1999년도
THE MERCK INDEX
12 edition
MERCK & CO.,INC
Paul G. Stecher
1996년도
HACKH′S CHEMICAL DICTIONARY
4th edtion
McGRAW-HILL BOOK COMPANY
Julius Grant 1
972년도
네이버 위키피디어


































소개글